Il concetto di biolisciviazione
La biolisciviazione consiste nell' estrazione dei metalli dai minerali o dai concentrati di solfuro, utilizzando componenti che si trovano facilmente nell'ambiente. Questi componenti sono principalmente:
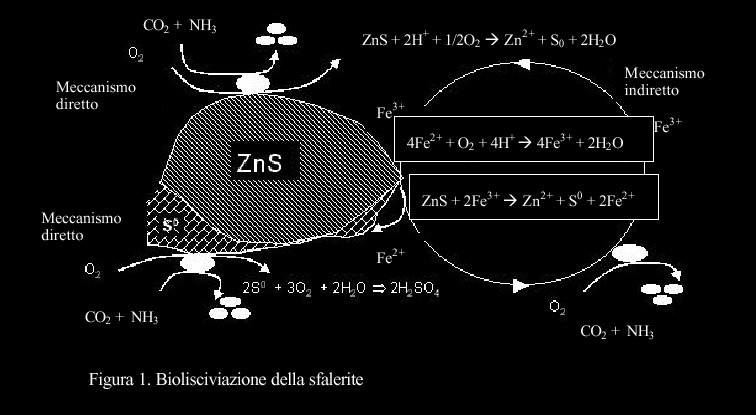
In termini chimici il processo può essere descritto nel miglior modo come una liscivia ferrica, con la riossidazione del ferro ferroso di nuovo a ferrico, con i microorganismi che intervengono come catalizzatori [5]. Lo zolfo elementare è frequentemente un sottoprodotto della biolisciviazione ed i microorganismi ne sono i responsabili per l'ossidazione ad acido solforico. Il metabolismo dei microorganismi si basa sull'ossidazione del ferro ferroso, sull' ossidazione dello zolfo e sulla fissazione dell' anidride carbonica. Si veda nella figura 1 un esempio di biolisciviazione per la sfalerite ( detta volgarmente blenda). Sulla questione biolisciviazione ci sono due teorie dominanti, anche se di fondo non è ancora risolto il meccanismo preciso secondo cui avviene l'intervento microbico[6]:
1) Meccanismo indiretto: si pensa che il processo generale di lisciviazione avvenga per ossidazione microbica degli ioni di ferro e per lisciviazione chimica del minerale.
2) Meccanismo diretto: si presuppone la totale catalisi microbica nella dissoluzione generale del minerale coinvolto nel processo. I microorganismi interagirebbero direttamente con il minerale.

La biolisciviazione accade naturalmente quando i microorganismi alterano lentamente le masse minerali di solfuri. Quando ciò avviene i microorganismi sono considerati un fenomeno indesiderato (si pensi ai drenaggi acidi che fuoriescono dai depositi a tenore submarginale delle miniere). Tuttavia, una volta limitato in un impianto di lavorazione, questo processo naturale e spesso indesiderato può essere sfruttato ed usato per l'estrazione dei metalli dai minerali o dai concentrati di solfuro. La biolisciviazione permette di vincere la refrattarietà dei minerali. I minerali si dicono refrattari quando una parte significativa del metallo in essi contenuto non può essere recuperata dall'estrazione semplice, oppure se il metallo interessato è "bloccato" con altri minerali o elementi come i solfuri e lo zolfo, oppure quando è presente del carbone elementare.
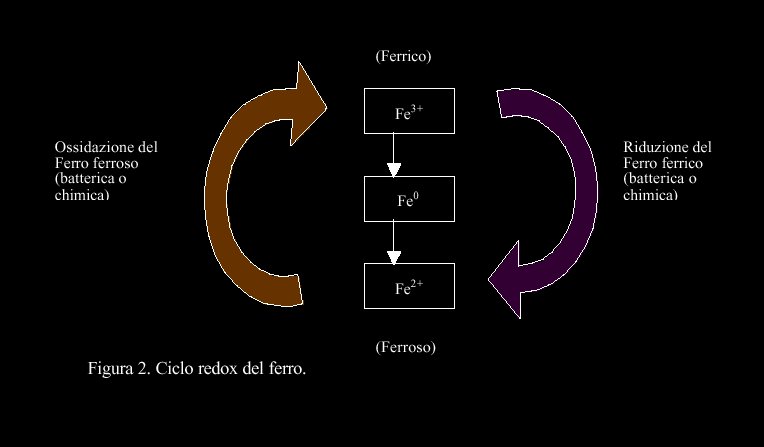
Il ciclo del ferro
Il ferro è uno degli elementi più abbondanti nella crosta terrestre. Esiste naturalmente in 2 stati di ossidazione, ferroso (Fe2+) e ferrico (Fe3+). Fe0 è un prodotto delle attività umane per fusione di minerali ferrosi o ferrici. In natura quindi, il ferro fa ciclo tra forme ferriche e ferrose. La riduzione del Fe3+ accade sia chimicamente sia attraverso la respirazione anaerobica; l'ossidazione del Fe2+ accade sia chimicamente e sia attraverso un metabolismo chemiotrofo [7]. L'unico elettrone accettatore capace spontaneamente di ossidare il Fe2+ è l' O2 (questo può accadere ad un pH neutro) ; per contrasto, a bassi pH, il Fe2+ è stabile, e questo permette una prolifica crescita batteri acidofili capaci di ossidare il ferro.
La riduzione batterica del ferro
E' bene fin da ora chiarire alcune definizioni sui batteri. I batteri chemiolitotrofi sono batteri autotrofi (cioè che usano come fonte di carbonio la CO2); prendono inoltre energia per organicare la CO2 (creando carbonio organico per la crescita) dall'ossidoriduzione di H2S, CO, Fe dei sedimenti [8]. Appartengono ai chemiolitotrofi: i solfobatteri, i carbossidobatteri e i ferrobatteri ( come il Thiobacillus ferroxidans). I batteri si classificano in base a :
· fonte di carbonio usata ETEROTROFI ( usano carbonio organico per la biosintesi, cioè la crescita ) AUTOTROFI ( usano carbonio inorganico per la biosintesi, specie CO2 )
· fonte di energia usata FOTOTROFI ( usano energia luminosa ) CHEMIOTROFI ( usano energia da reazioni red-ox) A questo gruppo appartengono i chemiolitotrofi che fanno reazioni red-ox nei sedimenti con Fe, S,CO. Un certo numero di organismi possono usare il ferro ferrico come ricettore dell'elettrone.
La riduzione ferrica del ferro è comune nei terreni permeabili, nelle paludi e nei sedimenti anossici di lago (sono quelli più profondi, dove a causa dello scarso movimento delle acque c'è poco ricambio di ossigeno che genera perciò condizioni riducenti). Il movimento delle acque freatiche ricche di ferro proveniente dalle paludi anossiche o dai terreni permeabili è causa del trasporto di grandi quantità di ferro ferroso. Una volta che questa acqua raggiunge le regioni ossigenate, il ferro ferroso è ossidato chimicamente o dai batteri del ferro, e i composti ferrici precipitano causando la formazione di depositi di ferro marrone [7]. La reazione generale spontanea di ossidazione ferrosa del ferro è:
![]()
L'idrossido ferrico precipita e può interagire con altre sostanze non biologiche, come quelle humiche, per ridurre Fe3+ di nuovo a Fe2+. Il ferro ferrico può anche formare complessi con i vari costituenti organici, diventando solubilizzabile e più disponibile ai batteri riduttori di ferro ferrico [7]. In figura 2 è illustrato il ciclo del ferro.