I gas perfetti
DEFINIZIONE
Iniziamo col dire che "perfetti" non significa che non hanno difetti ma semplicemente che si comportano in un certo modo nelle condizioni normali di temperatura e pressione.
Un gas è un insieme di molecole che a differenza degli altri stati della materia (solido e liquido) si trovano ditribuite in modo più "ampio". Proprio per questo motivo essi non hanno volume proprio e, liberi, tendono ad espandersi occupando tutto lo spazio disponibile, essendo esigue le forze coesive tra molecole ed atomi.
LA LEGGE DEI GAS PERFETTI
Il loro stato è caratterizzato da alcune variabili, ovvero:
temperatura
pressione
volume
Queste tre grandezze sono in relazione tra loro tramite una formula detta dei "gas perfetti".
P * V = n * R * T
dove P è la pressione, V è il volume del gas, n il numero di moli (ovvero la quantità del gas), R è una costante e T è la temperatura.
IL COMPORTAMENTO DEI GAS
Mantenendo costante una di queste quantità si crea una relazione tra le grandezze restanti.

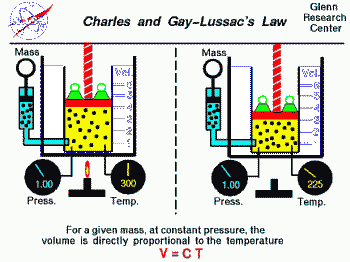
Infatti mantenendo la pressione costante si ha la legge di Charles
k * V = n * R * T,
dove k è una costante. In tal modo, poichè n ed R non cambiano, si ha k= T / V ovvero temperatura direttamente proporzionale al volume. Vale a dire quando si aumenta la temperatura tende ad aumentare anche il volume.
Da notare che tutti i gas, in condizioni normali, non hanno volume proprio e quindi, liberi, tendono ad espandersi occupando tutto lo spazio disponibile, essendo esigue le forze coesive tra tra le molecole e atomi.
Mantendendo costante il volume del gas si ha la legge di Gay-Lussac
P * k = n * R * T,
dove si ottiene la relazione k=T / P ovvero temperatura e pressione direttamente proporzionali e quindi ad un aumento della pressione corrisponde un aumento della temperatura.
Mantenendo infine la temperatura costante si ottiene la legge di Boyle
P * V = n * R * k,
in tal modo p=k / V e quindi un aumento della pressione provoca una diminuzione del volume e viceversa.
Queste tre leggi esprimono tutti i comportamenti dei gas in condizioni normali ed aiutano a comprenderne il comportamento.
ESEMPI PRATICI
Le formule sopra esposte possono essere facilmente spiegate attraverso esempi che ne chiariscono il significato. Innanzitutto si pensi al gas come una grande quantità di piccole "palline" distribuite in modo casuale larghe tra loro.
Ecco che se si pensa ad un contenitore contenente tali palline e ad un pistone che preme dall'alto possiamo facilmente spiegare cosa succede nelle tra leggi sopra esposte. Altra informazione necessaria è quella di capire che la temperatura altro non è che lo stato di agitazione di queste palline e quindi anche la loro velocità di movimento.
Mantenendo il pistone fermo (pressione costante), un aumento di temperatura corrisponde ad una agitazione maggiore delle palline che proprio per questo tendono ad espandersi nel contenitore. Invece mantenendo il volume costante si ottiene una aumento della temperatura di pari passo con la pressione perchè una agitazione maggiore delle palline provoca molti più urti verso le pareti del recipiente che ha un volume costante. Gli urti rappresetano appunto la pressione.
Infine un aumento della pressione schiaccia maggiormente le palline che hanno meno spazio per muoversi utilizzando un volume più piccolo. Viceversa un volume più piccolo costringe le palline a urtare più spesso le pareti del recipiente facendo aumentare la pressione.